Онкогенетика – краеугольный камень персонализированного лечения рака
Первые десятилетия XXI века стали временем стремительного взлета онкогенетики – научного направления, изменившего наши представления о механизмах возникновения опухолей и об их лечении. Новые знания о природе рака на молекулярно-генетическом уровне позволили сделать лечение действительно таргетным (от английского target – цель), учитывающим индивидуальные особенности течения болезни каждого пациента.
О том, зачем нужны исследования генома не только болеющим, но и здоровым людям, рассказывает заведующий лабораторией молекулярно-генетической диагностики Медицинского института им. Березина Сергея (МИБС) Марат Гордиев.
Молекулярно-генетические исследования в онкологии – довольно новая история?
В общем, да. Хотя исследования в этом направлении проводились еще в 50-е годы прошлого века, но бурный рост и клиническое применение метода во всем мире началось с 2010-х годов. Толчок онкогенетике дала «Большая фарма»: стали появляться препараты, с одной стороны, весьма дорогие, с другой – очень эффективные, которые невозможно назначить без генетического теста.
И, если в начале онкогенетика была «падчерицей» классической генетики, то сейчас она стала ее драйвером. Сегодняшние успехи в онкологии: огромное количество новых препаратов, современных методов лечения, понимание роли генома, – потребовали такого развития молекулярно-генетической диагностики, что она «потащила» за собой остальную генетику.
В каких случаях нужны молекулярно-генетические исследования?
Сегодня ни один врач химиотерапевт не может выбрать эффективную тактику лекарственного лечения без молекулярной генетики. При принятии решения о лечении, предположим, рака легкого, ему необходим целый спектр генетических и гистохимических маркеров, без которых невозможно назначить правильную терапию.
А эта терапия действительно эффективна, особенно если говорить про распространенные стадии – сейчас мы переживаем взрыв и эволюцию именно лечения поздних тяжелых метастатических форм заболеваний, таких как рак легкого, меланома, рак поджелудочной железы, предстательной железы и других. Каждому онкологу известен так называемый «эффект Лазаря», когда человек попадает в стационар совершенно обессиленным, не может встать с кровати, и буквально через несколько недель или даже дней приема современных лекарств поднимается на ноги. Конечно, это не чудодейственное исцеление, но продление жизни для пациента на несколько лет, причем – качественной жизни. Стоят такие препараты миллионы, и вдвойне обидно, если они не срабатывают из-за того, что назначены не тому пациенту. Молекулярно-генетическое исследование стоимостью пару десятков тысяч рублей может сэкономить бюджету огромные деньги.
То есть, молекулярно-генетические исследования необходимы, чтобы таргетно определить, что этому человеку подойдет именно этот препарат. И в ближайшие годы количество маркеров, необходимых для постановки диагноза, будет только увеличиваться, ведь мы быстрыми шагами идем к персонифицированной медицине. Мы в МИБС понимаем это и, открывая молекулярно-генетическую лабораторию, готовились к «забегу на длинную дистанцию»: из списка существующих маркеров мы уже сейчас можем делать большинство, и предполагаем наращивать компетенции.
Паспорт генетических рисков
Сейчас очень модная тема – генетический паспорт человека. В онкогенетике есть такие «паспорта»?
Многое, из того, что рекламируется: пройдите генетическое тестирование, и мы расскажем вам о том, что можно есть, чего нельзя, каким спортом заниматься, – не более, чем маркетинговые ловушки. Нет никаких научных доказательств, что сегодня исследования генома могут ответить на такие вопросы. Но генетический паспорт в онкогенетике все же есть.
Как известно, раковые опухоли образуются из-за генетических «поломок» – мутаций в одной из клеток человеческого организма, что провоцирует ее бесконтрольное деление. Почти в 75% случаев такие мутации возникают спорадически, под воздействием внешних мутагенных факторов – курения, ультрафиолетового или ионизирующего излучения и других.
Однако иногда члены одной семьи болеют одними и теми же видами рака чаще, чем обычно: около 25% выявляемых онкологических заболеваний относятся к так называемым «семейным формам рака». Нередко они вызваны генетическими мутациями, которые передаются из поколения в поколение, в десятки раз повышая предрасположенность к определённым (чаще всего – к нескольким) типам заболеваний.
На сегодня научно установлен перечень мутаций, который многократно увеличивает риски возникновения самых распространенных раков: молочной железы, яичников, предстательной железы, колоректального рака, меланомы кожи, желудка и поджелудочной железы (одно из самых опасных и скоротечных заболеваний в онкологии). Наследственные раки крайне опасны, их еще называют «интервальными», так как они успевают проявиться и развиться между двумя профилактическими осмотрами. Информацию о предрасположенности к ним как раз может дать онкогенетика – посредством секвенирования генома.
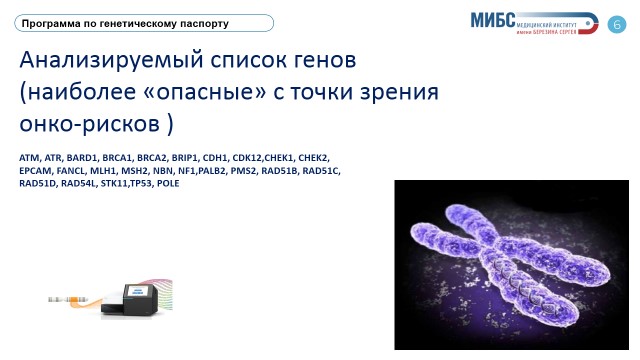
Применяемый нами метод секвенирования нового поколения (NGS) выявляют все известные на сегодня науке мутации, определяющие предрасположенность человека к онкологическим заболеваниям. Мы смотрим более 25 генов, мутации в которых значительно увеличивают риски возникновения 7 самых распространенных раков. С уверенностью скажу, что с таким количеством генов на высоком уровне сегодня никто в РФ не работает. В перспективе планируем заниматься и другими наследственными заболеваниями, например, кардиологическими.
Что дает человеку знание о наличии мутаций, связанных с «семейными раками»?
Выявление наследственной предрасположенности позволяет снижать риск развития рака у здоровых людей. Это периодические осмотры врачей, более часто назначаемая диагностика, изменение образа жизни, иногда – профилактическое лечение. Классический пример – широко известный случай Анджелины Джоли. После выявления наследственной мутации, повысившей ее риск заболеть раком молочной железы до 80%, она провела профилактическую мастэктомию и до сих пор жива, здорова и активна, хотя родственницы по материнской линии умирали до 55 лет.
В современной онкологии много усилий направлено на то, чтобы выявлять среди здоровых людей имеющих высокие риски заболеть и «ловить» рак на ранней стадии, когда он легче поддается лечению. Это следующий вектор развития онкогенетики, который мы тоже будем развивать. Опыт у нас уже есть: вместе с коллегами проводили в Поволжье исследование по выявлению наследственных раков в РФ, в которое включили 14 онкодиспансеров. Мы внедрили собственную методику и информационное обеспечение, проанализировали более 3 тысяч образцов, и на основе полученных данных создали уникальную карту, содержащую информацию о частоте встречаемости в РФ генетических мутаций, повышающих риски раков. По результатам исследования была создана OncoBRCA – первая в стране база данных по частоте мутаций генов BRCA1-2, ассоциированных с раком груди и яичников.
Ловить риски «широким бреднем»
Кому следует проходить секвенирование генома? Людям с онкологическим заболеванием в семейной истории?
С одной стороны, вы правы: те, в чьих семьях из поколения в поколение встречаются одни и те же виды рака, находятся в группе риска, и им, безусловно, следует пройти проверку на наличие наследуемых мутаций.
Но, с другой стороны, такова наша ментальность, что мы практически не знаем нашей семейной истории. Можете сходу назвать фамилию прадеда по материнский линии – со стороны бабушки? А сколько он прожил? А для генетики продолжительность жизни – достаточно важная информация. И этот пробел нивелируется большим количеством исследований. Когда ты четко знаешь, что в роду, начиная с четвертого поколения у этого человека, ныне здорового, был рак молочной железы, то понимаешь, мутацию какого гена искать. А когда человек начинает путаться, ничего не знает о прадедах, плохо представляет биографию дедов (да еще не забывайте сложную историю нашей страны), то эти «белые пятна» можно компенсировать только более гибкой методологии.
Что вы имеете ввиду?
Есть две модели выявления рисков наследственных раков. Первая простая: когда у пациента, особенно моложе 50 лет, уже есть заболевание, обнаружены мутации в генах, то надо провести секвенирование генома родственников. У нас был опыт, когда мы нашли мутировавший ген до четвертого колена. Есть плюсы и минусы. Плюсы – круг обследуемых определен, их не нужно искать. Минус – бездетные пациенты зачастую не заинтересованы в том, чтобы оповещать родственников о потенциальной угрозе их здоровью и рекомендовать им пройти генетические исследования, Мы же очень редко общаемся со своими троюродными братьями-сестрами, к примеру.
Второй путь – брать общую популяцию и всех секвенировать, отлавливая мутации широким бреднем. Повышенные риски обнаружим примерно у 1,5% населения, то есть в масштабах России это около 2 млн носителей «поломанных» генов, которым можно помочь избежать семейных раков. Минус в том, что приходится работать с огромным количеством людей и большими массами данными, что дорого для бюджета в краткосрочной перспективе, но в долгосрочной – экономит огромные средства (ведь лечение онкологических заболеваний становится не только более таргетированным, но и более дорогим). В США, к примеру, это понимают, и медицинские компании в рамках скрининговых программ исследуют риски, выявляют наследственную предрасположенность среди здоровых носителей и дают им рекомендации. Россия пока отстает. Но мы в МИБС уже пытаемся организовать работу со здоровыми людьми для выявления наследственных рисков развития рака, а также ведем работу, чтобы те, кто находится в группе риска из-за семейного анамнеза, могли проходить секвенирование генома по ОМС.
Как Россия выглядит на фоне других стран в плане внедрения онкогенетики в клиническую практику?
Мы, конечно, не впереди планеты всей, но и не сильно отстаем. Имею ввиду, во внедрении в клиническую практику, а не в науке. Основные разработки лекарственной терапии проводятся в США и Западной Европе, соответственно, исследования по онкогенетике проводятся преимущественно в этих странах. В этом смысле нам похвастаться нечем.
Что касается молекулярно-генетических лабораторий, то в последние десять лет они стали расти как грибы по всему миру. И мы на фоне мирового процесса – такие хорошие середнячки. Конечно, до США, где в развитие онкогенетики вкладывается и «Большая фарма», и государство, нам далеко, но задел для развития направления еще есть. В нашей стране сейчас работают около 20 лабораторий, которые занимаются молекулярно-генетическими исследованиями, причем не только в Москве и Санкт-Петербурге, но и в Уфе, в Казани. Они стали особенно быстро появляться с 2019 года – после включения МГИ в систему ОМС. Уровень их абсолютно разный, причем это не зависит от географии.

Что является показателем уровня лаборатории?
Тот спектр исследований, которые она может выполнять. Мутации с применением простых методов, например, тестов ПЦР, умеют делать все. Сложные исследования, требующие новых программ, математических моделей для анализа данных, под силу единицам. Секвенирование NGS могут делать только те лаборатории, в которых есть определенный кадровый потенциал: оборудование всегда можно купить, а хороших специалистов, как и везде, не хватает. Это аксиома.
Но нет смысла сравнивать друг с другом два десятка российских лабораторий, давайте лучше посмотрим на Запад – у них такие объемы и, соответственно, такие математические модели применяются, что мы просто дети по сравнению с ними. Мы отстаем не идеологически, повторюсь: современными технологиями мы владеем. Но у нас нет таких масштабных задач. Лаборатория клиники Майо в США, допустим, делает 5-6 тысяч исследований в месяц. При таких объемах ты всегда имеешь другую реагентику, другие системы обсчета – более быстрые, более массовые, – которые для нас избыточны. Задачи формируют методологию. Поэтому надо ориентироваться не на наши реалии, а сравнивать себя с такими примерами. Нам еще работать и работать.
Елена Владимирова