Преимущества протонов в лечении опухолей головы и шеи. Российский опыт
На карциномы области головы и шеи приходится около 6% всех злокачественных новообразований в мире, частота их возникновения составляет около 7 случаев на 100 тысяч выявленных онкологических заболеваний. Согласно современным подходам, в лечении этих опухолей в большинстве случав применяется лучевая терапия.
Трудности радиотерапии в области головы и шеи
Особенности лучевой терапии новообразований головы и шеи – это большой объем облучаемых тканей и множество критических структур, расположенных в данной анатомической области. Гистологически опухоли, наиболее часто встречающиеся в этой локализации, диктуют необходимость подведения высоких суммарных доз.
Вследствие этого у пациентов возникают острые местные лучевые реакции, такие как острый лучевой мукозит, дерматит, дисфункция слюнных желез. Такие побочные эффекты лечения не только значительно ухудшают качество жизни пациента и снижают его повседневную активность, но и зачастую приводят к вынужденным перерывам в курсе радиотерапии, влияя в итоге на эффективности лечения и на выживаемость больных.
Через несколько месяцев после завершения курса лучевой терапии у пациента могут возникнуть отсроченные побочные эффекты, такие как:
- ксеростомия (недостаточное слюноотделение)
- дисгевзия (нарушение вкуса)
- повышенный риск аспирации (попадание пищи и жидкости в дыхательные пути)
- дисфункция щитовидной железы
- тризм (спазм жевательной мускулатуры)
- остеонекроз (омертвление костной ткани)
- кариес
- трофические язвы слизистой оболочки и кожи
Поздние лучевые повреждения значительно снижают качество жизни пациентов, И крайне сложная задача, стоящая перед врачом, – подвести максимально возможную дозу, минимально задев здоровые ткани.
Как обойти критические структуры
Нужного эффекта позволяет достичь протонная терапия – современный метод лучевого лечения, в котором вместо фотонов (рентгеновских лучей) для доставки дозы в мишень применяются протоны (ядра атома водорода).
Многотонные современные установки для подачи пучка протонов в мишень, со скоростью один оборот в минуту вращаясь вокруг пациента, позволяют добиться высочайшей точности облучения. Геометрическая погрешность протонной терапии – менее трех десятых миллиметра. Дозиметрические преимущества протонов определяются так называемым пиком Брэгга – свойством тяжелых заряженных частиц доставлять всю дозу радиации в конечную точку пробега, без выходной дозы за пределами мишени. Соответственно, при планировании в теле пациента можно создать области, не затрагиваемые радиацией, причем в непосредственной близости от облучаемых целевых объемов, снизив или предотвратив полностью радиационную нагрузку на нормальные ткани и на критические структуры.
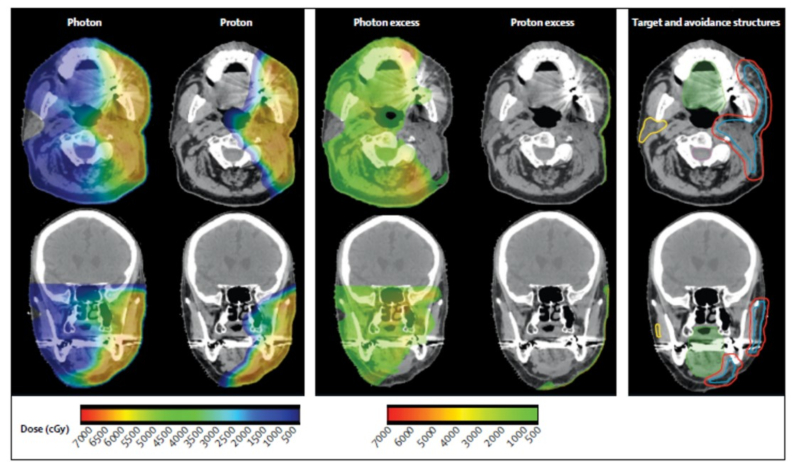
Рис 1: Дозное распределение IMRT и IMPT при послеоперационном облучении ложа околоушной слюнной железы
Изображения сравнительных дозиметрических планов для фотонного и протонного облучения. В обоих случаях выбраны одинаковые изодозы, подаваемые в мишень. В среднем ряду изображений видно, что при фотонной терапии избыточная доза попадает на нецелевые объемы. Области в полости рта и окололатеральная слюнная железа получают средние и низкие дозы облучения, что в к конечном итоге может привести к более выраженным острым лучевым реакциям и отдаленным последствиям.
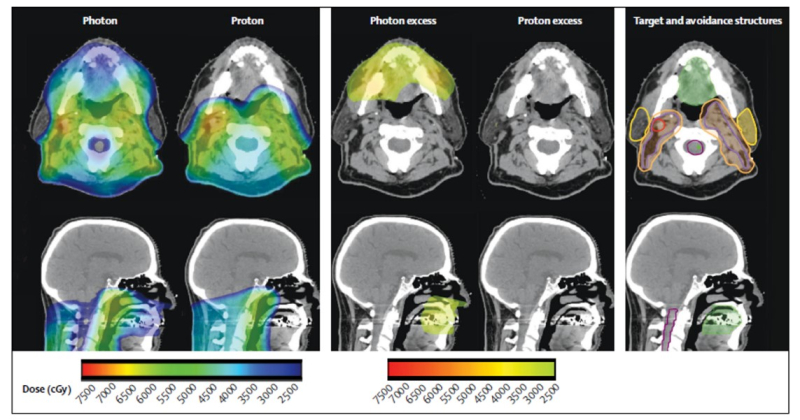
Рис 2.: Возможности снижения дозы на слизистую ротовой полости
Протонная лучевая терапия позволяет снизить дозу на ротовую полость даже при таком сложном клиническом сценарии, как облучение шейных лимфатических узлов высокой дозой с двух сторон. Слева мы видим избыточную дозу при фотонном облучении.
Тем не менее, при планировании протонной лучевой терапии необходимо учитывать ее особенности и риски. В клинической практике, как правило используется, модифицированный пик Брэгга, с модуляцией по энергии протонов, который позволяет охватить весь объем опухоли. Но нужно помнить, что его применение повышает входную дозу пучка по сравнению с аналогичным фотонным пучком, что необходимо учитывать при оценке нагрузки на кожу. В сравнительном когортном ретроспективном исследовании (Romesser et al, 2016) отмечалось, что в ходе лечения острые лучевые дерматиты возникли у 100% пациентов, проходящих терапию протонами, против 74% – в группе с фотонной лучевой терапией.
При протонной лучевой терапии опухолей, локализующихся в носоглотке и в придаточных пазухах носа, удается добиться улучшения локального контроля над новообразованием и общей выживаемости пациентов. Но одновременно – была выявлена более высокая частота поздних лучевых повреждений критических структур центральной нервной системы. Авторы исследования (Patel et al, 2014) связывают это с тем, что в группу пациентов, получающих протонную терапию, входили самые сложные клинические случаи с более близким расположением критических структур и целевых облучаемых объемов. А также – с отсутствием точного учета коэффициента линейного переноса энергии, вследствие чего относительная биологическая эффективность протонного излучения оказывалась равной не 1,1, как это принято считать, а в области пика Брэгга она достигала 1,2-1,25, что может приводить к непредвиденным лучевым повреждениям. Избежать превышения дозы на критическую структуру последствий позволяет использование более точной модели планирования с учетом линейного переноса энергии.
Исследования подтверждают преимущества протонов
Научные исследования, результаты которых активно публикуются в последние 5-7 лет, подтверждают, что протонная терапия дает хорошие результаты в лечении опухолей головы и шеи, снижая риски побочных эффектов. Так, в сравнительном когортном ретроспективном исследовании (Romesser et al, 2016) отмечается, что острые мукозиты во время лечения протонами возникают у 17% пациентов, фотонами – у 52%, тошнота – у 17% и 70% соответственно, утомляемость – у 39% и 91%.
Одной из наиболее сложных локализаций опухолей головы и шеи в плане острых лучевых реакций является ротоглотка: основание языка, небные миндалины, стенки самой ротоглотки. При фотонной терапии при использовании компланарных планов такие области, как слизистая ротовой полости, околоушные железы, находятся в плоскости самой мишени и получают существенную дозу.
В исследовании, опубликованном три года назад (Apinorasethkul O, Kirk M, Teo K, Swisher–McClure S, Lukens JN, Lin A., Med Dosim. 2017), было показано существенное снижение дозы на ротовую полость при использовании протонной лучевой терапии при лечении рака этой локализации. При этом покрытие целевых объемов при протонной и фотонной лучевой терапии не различалось.
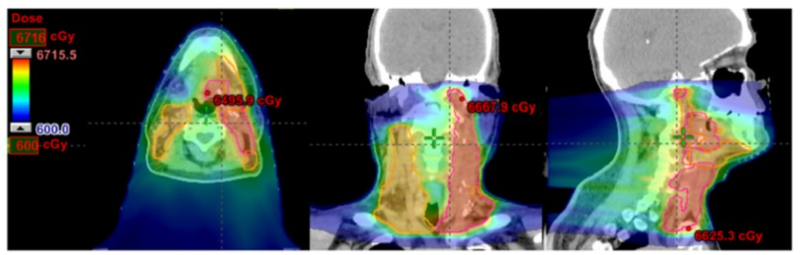
Рис. 3: Сравнение покрытия мишени при протонной и фотонной терапии.
Распределения дозы при фотонной (верхний ряд) и протонной (нижний ряд) лучевой модулированной по интенсивности терапии. Нижний ряд – это модулированная по интенсивности протонная лучевая терапия. При лечении протонами контралатеральная полвины рта и нижняя челюсть выведена из высокодозного облучения, что улучшает переносимость лечения пациентом и уменьшает риски отдаленных осложнений, таких, как пострадиационный кариес зубов.
У пациентов с раком ротоглотки по результатам сравнительных когортных ретроспективных исследований было установлено, что потребность в гастростоме энтерального питания возникает у 65% пациентов при лечении фотонами и только у 20% – при лечении протонами (Holiday et al, 2015). Через год после завершения курса лучевой терапии (Blanchard et al, 2016) 25% пациентов, прошедших фотонную терапию, продолжали пользоваться гастростомическими трубками или потеряли более 20% веса. После лечения протонной лучевой терапией такие состояния были отмечены только у 8% пациентов.
Кроме того, в исследованиях оценивалась скорость восстановления пациентов с раком ротоглотки после проявления острых лучевых реакций. И, если первые три месяца достоверных в группах, прошедших лечение протонами и фотонами различий практически не было (за исключением проблем с зубами), то уже на точке 6 и 12 месяцев отмечено более быстрое восстановление пациентов, получивших протонную терапию.
Особенно важно было более быстрое восстановление всех социальных ролей и функций: после лечения протонами человек быстрее возвращается к своей обычной жизни.
Опыт МИБС в протонной терапии опухолей головы и шеи
Медицинский институт им. Березина Сергея (МИБС) осенью 2017 года открыл первый в РФ клинический центр лучевой протонной терапии, и с начала 2018 года начал активное лечение пациентов протонами. За три года работы Центра прошли лечение 169 пациентов с опухолями головы и шеи ( примерно каждый десятый). Для анализа были выбрали 16 пациентов с местно-распространёнными формами рака ротоглотки III-IV стадии. Предписание дозы было таким же, как при лечении в отделении фотонной лучевой терапии Онкологической клиники МИБС с использованием пучка фотонов с объемной модуляцией.
Было определено три уровня дозы: на первичный очаг – эквивалент 70 Гр, на лимфатические узлы высокого и низкого риска – эквивалент 60Гр и 55 Гр соответственно. Режим облучения – стандартное фракционирование 5 дней в неделю. Пациенты получали одновременно химиотерапию – высокодозный цисплатин 100 мг/м2, в 1, 22, 43 дни лечения.
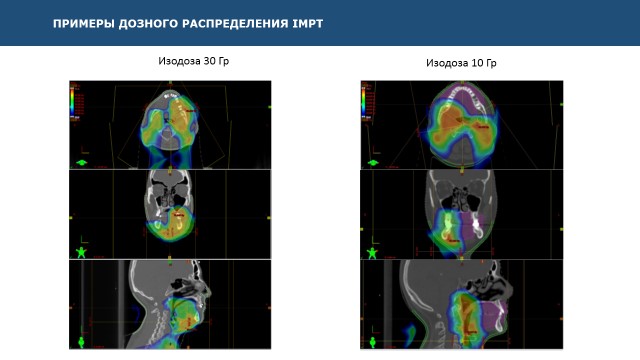
Рис. 4: В колонке слева – изображение областей, получивших дозу 30 мГр. Именно эта доза вызывает развитие мукозита полости рта второй степени и выше. Мы видим, что часть ротовой полости, не входящая в объем мишени, не получает радиационной нагрузки.
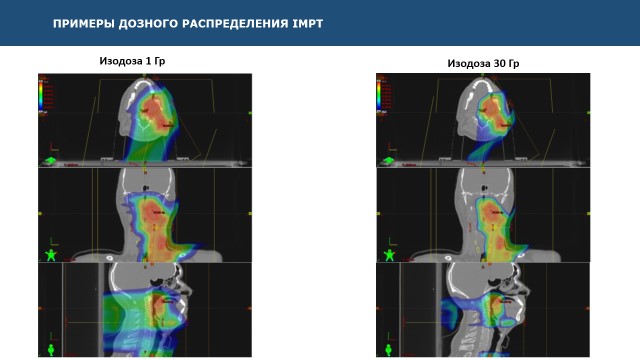
Рис. 5: Облучение шейных лимфатических узлов дозой 60 Гр (первичный очаг располагается в правой небной миндалине). На большей части слизистой рта радиационная дозы не достигала 10 Гр. Соответственно, нижняя челюсть была выведена из области высокой дозы, что существенно снижает риск развития пострадиационного кариеса.
Врачами МИБС были установлены достоверные различия в дозной нагрузке на слизистую ротовой полости при лечении протонной и фотонной лучевой терапией. Пациенты, проходившие лечение протонами, существенно лучше переносили лечения, никому не потребовался перерыв курса.
Протонная терапия сканирующим пучком, применяемая в протоном центре МИБС, позволяет снизить дозные нагрузки на критические органы при облучении орофарингеальной зоны, что приводит к снижению частоты поздних лучевых повреждений, улучшению переносимости лечения, а также сокращению сроков разрешения ранних лучевых реакций
Дозные градиенты при протонной терапии определяют необходимость в более точном оконтуривании облучаемых объемов. Необходимы дальнейшие исследования для определения группы пациентов, которым проведение протонной терапии будет наиболее оправдано.
 Статья подготовлена на основе доклада на XII Международном Невском радиологическом форуме в апреле 2021 г.
Статья подготовлена на основе доклада на XII Международном Невском радиологическом форуме в апреле 2021 г.
Автор доклада: Михайлов Алексей Валерьевич, кандидат медицинских наук, врач-радиотерапевт, заведующий отделением лучевой терапии Медицинского института им. Березина Сергея (МИБС)