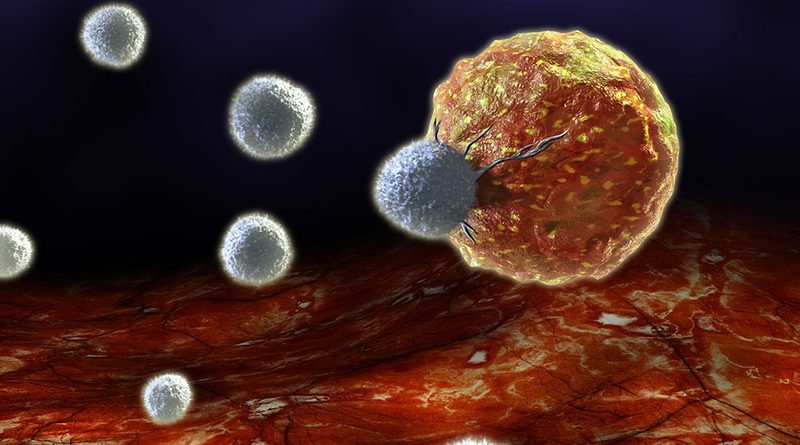
Как снизить устойчивость опухолей к радиотерапии?
Новые исследования дают ответ на вопрос: как снизить устойчивость иммунной системы к лучевой терапии для более эффективной борьбы с опухолями?
Причина устойчивости иммунной системы к лучевой терапии, указывается в трех исследованиях, проведенных параллельно, связана с регуляторными Т-клетками (Treg), контролирующими иммунный ответ через регуляцию функции Т-эффекторных клеток, не давая им разрушать здоровые ткани. Однако эта функция также предотвращает уничтожение злокачественных клеток Т-эффекторными клетками. Исследователи обнаружили, что в сочетании с другими факторами, уменьшение количества Treg клеток приводит к снижению устойчивости к лучевой терапии, что делает этот подход мощным иммунотерапевтическим средством.
«Геномика и характеристики злокачественных клеток по-прежнему имеют большое значение, но не менее важно и микроокружение опухоли, – сказал Сана Карам, доцент кафедры радиационной онкологии в Университете Колорадо. – Мы облучаем злокачественное новообразование пациента полностью, и радиация действует на клетки опухоли и другие клетки внутри опухоли. Некоторые из эффектов облучения будут подавлять рост злокачественных клеток, а другие, может, не будут. Чтобы можно было говорить о полном уничтожении опухоли, мы должны задействовать все преимущества облучения, направленные на подавление роста опухоли, и преодолеть все свойства облучения, способствующие росту опухоли».
Радиационная стимуляция иммунной системы для воздействия на злокачественные клетки по всему организму впервые была замечена радиационными онкологами более десяти лет назад и привела к многочисленным попыткам повторить эти действия и создать системную противораковую активность путем сочетания радиотерапии с иммунотерапией. Однако эти попытки не увенчались успехом даже при использовании тройной терапии и различных таргетных стратегий.
Одной лишь лучевой терапии было недостаточно для уничтожения рака головы и шеи у лабораторных мышей в первом исследовании. Снижение количества Treg клеток, как самостоятельная терапия, приводило к аналогичным результатам. Однако при совместном применении этих двух подходов наблюдалось сильное уменьшение опухолей, при этом излучение действовало как стимулятор, который «включал» Т-эффекторные клетки иммунной системы и заставлял их атаковать рак. Между тем, уменьшение Treg клеток не позволяло раку «выключать их».
Этот подход имеет свои ограничения, так как не существует агента, способного безопасно уничтожать Treg клетки у людей. Однако исследование может предложить возможное решение путем ингибирования связи между белками EphB4 и ephrinB2. Исследования, важные для изучения нейрогенеза в развивающемся мозге, выявили усиление экспресcии обоих белков при различных формах рака, включая злокачественные опухоли головы и шеи, а также поджелудочной железы. Ингибирование взаимодействия между ними снижает рост опухолей, одновременно сокращая количество Treg клеток.
Причины этого изучались в третьем исследовании, в котором ингибирование ephrinB2 применялось на моделях рака поджелудочной железы. Такой подход с ephrinB2 раньше приводил к плохим прогнозам, но, благодаря сотрудничеству с несколькими партнерами, было обнаружено, что ингибирование ephrinB2 уменьшает «фиброз» в опухолях, сжимая их менее плотно поперечными коллагеновыми волокнами.
Поскольку известно, что эти волокна делают опухоли поджелудочной железы менее проницаемыми для противораковых лекарств, менее уязвимыми для иммунной системы и более склонными к метастазированию, их сокращение уменьшает резистентность и позволяет иммунной системе, стимулируемой лучевой терапией, более активно атаковать и уничтожать злокачественные клетки.
«Понимая, как Treg клетки попадают в опухоль, как T-клетки, которые обычно становятся эффекторными T-клетками, преобразуются в Treg, что используют Treg клетки, чтобы оставаться живыми, и что притягивает Treg клетки к опухоли, мы надеемся разработать Treg мишени нового поколения, которые потенциально могут взаимодействовать с излучением, – сказал Карам. – Не менее важным для решения этой головоломки является понимание того, почему в некоторых опухолях нет Treg клеток, а в других есть. Использование разнообразной биологической гетерогенности будет не только ключом к определению новых целей, но и может дать нам представление о том, как выявлять биомаркеры ответа на определенные методы лечения».
Результаты первого исследования были опубликованы в журнале Journal of the National Cancer Institute, а результаты второго и третьего исследований были опубликованы в изданиях Cancer Research и Clinical Cancer Research, соответственно.
Джон Р. Фишер
На фото: В результате серии исследований были определены потенциальные пути снижения сопротивляемости иммунной системы для более эффективной борьбы со злокачественными клетками